Comissão Central de Farmácia e Terapêutica (CCFT)
A Comissão Central de Farmácia e Terapêutica (CCFT) é a instância colegiada de caráter permanente, de natureza consultiva e deliberativa, subordinada à Secretaria Adjunta de Assistência à Saúde (SAA/SES/DF) que tem como finalidade avaliação da Relação de Medicamentos Padronizados (REME-DF) da Secretaria de Saúde do Distrito Federal. A CCFT realizara dentre outras funções seleção de medicamentos nos diversos níveis de complexidade do sistema e definição de critérios para a incorporação de novas tecnologias farmacêuticas.
Regimento interno da Comissão Central de Farmácia e Terapêutica
Contatos
Telefones: (61) 2017-7073
Ramal: 1073
E-mails: ccft.sais@saude.df.gov.br e cft.ses.df@gmail.com
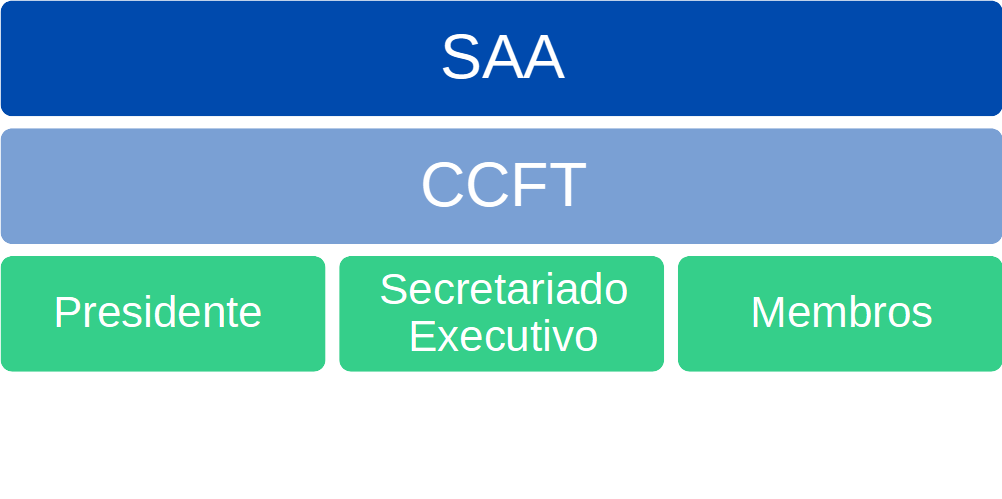
Organograma
Atribuições da CCFT
De acordo com o Art. 3° da Portaria n° 716, de 25 de 25 de novembro de 2022, são competências comuns às Comissões de Padronização da SES /DF:
- Subsidiar a SES/DF nos assuntos referentes à seleção de tecnologias em saúde e itens nos diversos níveis de complexidade do sistema;
- Revisar, atualizar e divulgar os seus respectivos catálogos de itens padronizados;
- Avaliar e emitir parecer sobre as solicitações de inclusão, exclusão ou alteração de tecnologias em saúde ofertados no âmbito da SES/DF;
- Avaliar sobre as solicitações de inclusão, exclusão ou alteração de itens que serão utilizados internamente no âmbito da SES/DF;
- Definir critérios racionais e parâmetros de avaliação, considerando as particularidades da tecnologia ou item alvo de padronização, adequados às necessidades de saúde da população do Distrito Federal para a incorporação, exclusão ou alteração de novas tecnologias no âmbito da SES/DF;
- Atualizar e revisar no sistema de materiais da SES e nos respectivos catálogos as inclusões, exclusões ou alterações deliberadas.
Ainda em consonância com o Art. 2° parágrafo 4° da mesma Portaria a CCFT é responsável pela padronização de medicamentos, insumos farmacêuticos ativos ( IFAs) e não ativos ( excipientes); cosméticos e gases medicinais.
Todos os itens precisam ter registro ativo na ANVISA, exceto os notificados, excipientes e IFAs que não possuem obrigatoriedade de registro.

Reuniões
De acordo com o Art. 20° da Portaria n° 716 de 25 de novembro de 2022 o quórum mínimo para realização das reuniões do Plenário será de maioria simples dos membros.
| CALENDÁRIO DE REUNIÕES ORDINÁRIAS CCFT 2024 | ||
| MÊS | EVENTO | DATA |
| Janeiro | 1ª Reunião Ordinária | 31/01/2025 |
| Fevereiro | 2ª Reunião Ordinária | 24/02/2025 |
| Março | 3ª Reunião Ordinária | 31/03/2025 |
| Abril | 4ª Reunião Ordinária | 28/04/2025 |
| Maio | 5ª Reunião Ordinária | 19/05/2025 |
| Junho | 6ª Reunião Ordinária | 30/06/2025 |
| Julho | 7ª Reunião Ordinária | 28/07/2025 |
| Agosto | 8ª Reunião Ordinária | 25/08/2025 |
| Setembro | 9ª Reunião Ordinária | 29/09/2025 |
| Outubro | 10ª Reunião Ordinária | 20/10/2025 |
| Novembro | 11ª Reunião Ordinária | 24/10/2025 |
| Dezembro | 12ª Reunião Ordinária | 15/12/2025 |
Submissão de propostas
Documentação
Para que se proceda a análise de incorporação de uma nova tecnologia pela CCFT é necessário que o solicitante ou área técnica siga as orientações estabelecidas no Manual de Padronização de Produtos e Incorporação de Tecnologias em Saúde na SES-DF, e encaminhe os seguintes documentos:
1) Formulário Padrão CCFT
A submissão de demandas à CCFT deve ser realizada por meio do Sistema Eletrônico de Informações (SEI) preenchendo o Formulário de Incorporação de Medicamentos, e assinando o mesmo.
Atenção: É fundamental que o formulário seja preenchido corretamente. O não preenchimento adequado do formulário implicará na análise técnica pela CCFT.
2) Declaração de conflito de interesse
Após preenchimento do Formulário de Incorporação de Medicamentos, o solicitante deverá incluir e preencher adequadamente o documento Termo de Conflito de Interesse, disponível no SEI
3) Sugestão de Protocolo Clínico
O envio de proposta de solicitação de padronização está implicado a apresentação de protocolo clínico que deverão conter apenas medicamentos, insumos e procedimentos padronizados no âmbito da SES-DF. As instruções e documentos necessários estão disponíveis aqui.
4) Documentação Técnico-Científica
O solicitante deverá enviar junto a solicitação documentação/estudos embasados na melhor evidência disponível, que comprove eficácia e segurança do(s) medicamento(s) requerido(s) para a(s) indicação(ões) solicitada(s).
Atenção: A documentação técnico-científica deverá conter pelo menos dois estudos publicados e classificados com o melhor nível de evidência, preferencialmente revisões sistemáticas de ensaios clínicos controlados randomizados.
Solicitação de Incorporação
Critérios para incorporação e desincorporação
A seleção de medicamentos terá como referência a Relação Nacional de Medicamentos Essenciais (RENAME) do Ministério da Saúde com o propósito de selecionar aqueles mais adequados para atender as necessidades de assistência à saúde da maioria da população, de acordo com dados epidemiológicos regionais.
A CCFT observará os seguintes critérios para seleção dos medicamentos:
- Tenham registro na Anvisa, em conformidade com a legislação sanitária;
- Estejam, preferencialmente, disponíveis no mercado nacional;
- Carga da doença, privilegiando aqueles medicamentos para doenças que configuram problemas de saúde pública;
- Valor terapêutico comprovado, com base nas evidência científica disponível relativo a seu uso em seres humanos, com destaque a sua segurança, eficácia e efetividade;
- Correspondam, preferencialmente, a medicamentos com único princípio ativo, admitindo-se combinações em doses fixas que atendam ao item I e possuam identificação do principio ativo, conforme Denominação Comum Brasileira (DCB), ou, na sua falta, pela denominação comum internacional (DCI);
- Possuam informações suficientes referentes às suas características farmacocinéticas, farmacotécnicas e farmacodinâmicas;
- Tenham menor custo de aquisição, armazenagem, distribuição e controle;
- Tenham menor custo no tratamento/dia e custo total de tratamento, resguardadas sua segurança, eficácia, qualidade e disponibilidade orçamentária;
- Apresentem concentrações e formas farmacêuticas, esquema posológico e apresentações, que atendam a maioria dos pacientes.
A despadronização de medicamentos da Reme será justificada quando:
- Não houver consumo significativo do produto;
- Indisponibilidade permanente no mercado brasileiro;
- Processo de padronização não atender aos critérios da comissão;
- Evidência científica que justifique a despadronização; e
- Indisponibilidade de formas farmacêuticas capazes de atender a demanda.
A substituição de medicamentos será justificada quando houver:
- Menor risco/benefício;
- Menor custo/tratamento;
- Menor custo de aquisição, armazenamento, distribuição e controle;
- Maior estabilidade;
- Menor toxicidade;
- Maior eficácia e eficiência;
- Maior facilidade na dispensação e administração.
Tecnologias Demandadas
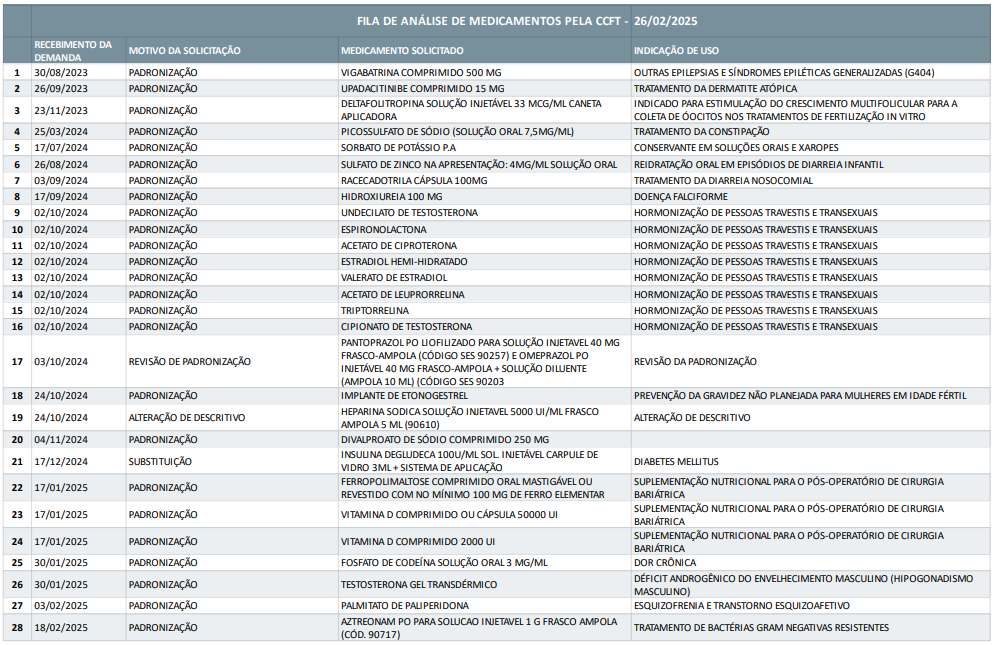
Medicamentos solicitados e posição na fila de análise pela CCFT SES/DF
Nessa seção são apresentadas as demandas de tecnologia em processo de avaliação pela CCFT que estão em conformidade documental. Aqueles processos em que há qualquer pendência por parte dos solicitantes foram recepcionados pela Comissão, porém precisam cumprir todos os quesitos legais obrigatórios para entrarem na fila de avaliação. Nesse contexto, a tabela acima pode ser alterada na medida em que as demandas forem solucionadas. Importante lembrar que o critério utilizado por essa Comissão é o cronológico, do mais antigo até o mais recente.
Relatórios Técnicos
As notas técnicas de revisão rápida (NTRRs) são estudos de ATS que envolvem métodos de revisão rápida da literatura mais sucintos que o parecer técnico-científico (PTC).
As NTRRs são documentos de síntese que priorizam revisões sistemáticas, estudos de avaliação de tecnologias e ensaios clínicos.
Links úteis
Anvisa
Cochrane
Portal Regional da BVS
Word Health Organization
Medline
PubMed
ATC
DDD
REME
RENAME